NEXUS Magazin: https://www.nexus-magazin.de/artikel/lesen/was-genau-sind-exosomen
Was genau sind Exosomen?
 Immer wieder tauchen sie in der Virendebatte auf, diese ominösen Vesikel. Viren sind nichts anderes als Exosomen, heißt es von Kritikern. Kann das stimmen? Wir haben uns gefragt, wie eigentlich der offizielle Stand der Forschung ist, und Ihnen einen Überblicksartikel übersetzt. Ziehen Sie Ihre eigenen Schlüsse daraus.
Immer wieder tauchen sie in der Virendebatte auf, diese ominösen Vesikel. Viren sind nichts anderes als Exosomen, heißt es von Kritikern. Kann das stimmen? Wir haben uns gefragt, wie eigentlich der offizielle Stand der Forschung ist, und Ihnen einen Überblicksartikel übersetzt. Ziehen Sie Ihre eigenen Schlüsse daraus.
Zusammenfassung
Exosomen sind extrazelluläre Vesikel, die vor 30 Jahren erstmals beschrieben wurden und seither nicht nur mit der Kommunikation zwischen Zellen und der Ausbreitung von Krankheiten im Körper in Verbindung gebracht, sondern auch als Hilfsmittel bei der Entwicklung von Medikamenten erforscht werden. Grundlegende Fragen über ihre biologische Bedeutung sind allerdings bis zum heutigen Tag unbeantwortet. In diesem Beitrag erörtere ich, was Exosomen sind, beleuchte die Schwierigkeiten, die mit ihrer Erforschung zusammenhängen, erkläre die aktuelle Definition und gehe einigen offenen Fragen der Exosomenbiologie nach.
Wie lautet die aktuelle Definition von Exosomen?
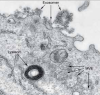
Das ist eine sehr gute Frage. Seit der Erstbeschreibung der Exosomen vor mehr als 30 Jahren wird der Begriff recht unpräzise für die unterschiedlichsten extrazellulären Vesikel verwendet. Dies führt zu Verwirrung und trägt zu der Skepsis bei, mit der sich die einschlägige Forschung zuweilen konfrontiert sieht. Exosomen fasst man am besten als extrazelluläre Vesikel auf, die von Zellen freigesetzt werden, sobald intermediäre endozytotische Kompartimente – die sogenannten multivesikulären Endosomen (MVE, auch als multivesikuläre Körperchen bezeichnet) – mit der Zellmembran verschmelzen. Dabei werden intraluminale Vesikel (ILV) in das extrazelluläre Milieu abgegeben. Diese freigesetzten Vesikel bezeichnen wir als Exosomen (Abb. 1).
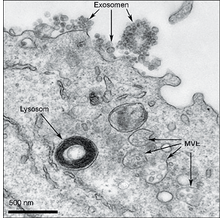
Abb. 1: Exosomen entsprechen intraluminalen Vesikeln, die sich in multivesikulären Endosomen (MVE) befinden. Auf dieser mithilfe eines Transmissionselektronenmikroskops angefertigten Aufnahme einer durch Epstein-Barr-Viren transformierten B-Zelle kann man Exosomen erkennen, die soeben von der Plasmamembran nach außen abgegeben worden sind. Rechts unten im Bild befinden sich die MVE, die ihren Inhalt entweder an Lysosomen liefern, damit sie ihn abbauen oder mit der Plasmamembran verschmelzen, um die intraluminalen Vesikel als Exosomen freizusetzen (Pfeile im oberen Bildteil).
Es gibt auch noch andere extrazelluläre Vesikel, beispielsweise apoptotische Körperchen und Ektosomen. Diese stammen von absterbenden Zellen bzw. werden von der Plasmamembran abgeschnürt. Obwohl apoptotische Körperchen, Ektosomen und Exosomen so manche Gemeinsamkeit aufweisen (zum Beispiel enthalten sie alle ein „Schlückchen“ Zytoplasma), handelt es sich um verschiedene Vesikelklassen. Es ist sehr wichtig, die Unterschiede zwischen ihnen zu verstehen, doch werden sie allzu häufig vernachlässigt.
Wie hat man Exosomen entdeckt?
Bereits vor 50 Jahren wurden membranumhüllte Vesikel außerhalb von Zellen nachgewiesen. Damals nahm man jedoch an, dass es sich um Strukturen zur Beseitigung von zellulärem Abfall handelte, die sich von der Plasmamembran ablösen. 1983 konnten bei Untersuchungen über den Verlust des Eisentransportproteins Transferrin Strukturen nachgewiesen werden, die wir heute als Exosomen bezeichnen.1 Indem man den Weg von mit kolloidalem Gold markiertem Transferrin durch das Endomembransystem verfolgte, konnte aufgezeigt werden, dass intraluminale Vesikel, die in multivesikulären Endosomen entstehen, mit der Plasmamembran verschmelzen2 und in den extrazellulären Raum freigesetzt werden; allerdings wurde der Begriff „Exosom“ für diese Vesikel erst 1987 geprägt.3
Doch wurden die Exosomen kaum beachtet, übergangen und – nicht zum ersten Mal – als Mechanismus zur Beseitigung von Abfall abgetan. Erst im vergangenen Jahrzehnt ist das Interesse an Exosomen explodiert – in diesem Zeitraum hat sich die Zahl der wissenschaftlichen Publikationen nahezu verzehnfacht (von 115 Publikationen im Jahr 2006 auf 1.010 im Jahr 2015).
Worauf beruht das gesteigerte Interesse an Exosomen?
Dafür gibt es mindestens drei Gründe. Erstens wird angenommen, dass Exosomen für die interzelluläre Kommunikation und den Austausch von Makromolekülen zwischen Zellen von Bedeutung sind. Zweitens: Im vergangenen Jahrzehnt wurden Exosomen mit der Verteilung von Proteinen, Lipiden, mRNA, Mikro-RNA und DNA im Körper in Verbindung gebracht und als Faktor erkannt, der die Entwicklung verschiedener Krankheiten beeinflusst. Drittens: Exosomen wurden als zweckmäßiges Transportvehikel für Medikamente ins Spiel gebracht, weil sie nicht aus synthetischen Polymeren, sondern aus Membranmaterial bestehen und deshalb vom Empfänger besser vertragen werden. Exosomentherapien werden mittlerweile in klinischen Studien zur Behandlung von Krebs erforscht. In aktuellen Studien wird berichtet, dass für die Behandlung von krebskranken Mäusen mit Taxol ein Fünfzigstel der herkömmlichen Dosis ausreicht, wenn das Zytostatikum innerhalb von Exosomen verabreicht wird – mit dem zusätzlichen Vorteil, dass die Vesikel keine Abwehrreaktion auslösen.4
Trotz 20-jähriger Bemühungen steckt die Erforschung der Grundlagen der Exosomenbiologie noch in den Kinderschuhen, sodass wir nach wie vor nur wenig über die Funktion der Vesikel in gesunden Körperzellen wissen.
Wissen wir, wie sich Exosomen bilden?
Ja und nein. Wir wissen, dass sie im Inneren von Endosomen als intraluminale Vesikel entstehen. Aber hier muss vorangestellt werden, dass sich nicht alle intraluminalen Vesikel zu Exosomen entwickeln und dass der Bildungsmechanismus noch nicht zur Gänze geklärt ist. Bei üblichen Abschnürungsvorgängen wird die Membran eines Organells in das Zytoplasma ausgestülpt, bei der Bildung von intraluminalen Vesikeln stülpt sich die Membran in das Endosom hinein, also weg vom Zytoplasma. Eine derart ungewöhnliche Abschnürung ist auf einen speziellen Mechanismus angewiesen; die Methode ist übrigens nicht auf die Bildung der Exosomen-Vorläufer beschränkt, sondern findet auch während der Einknospung von behüllten Viren aus dem Zytosol und während der Zellteilung statt.5
Intraluminale Vesikel, die späteren Exosomen also, können durch mindestens zwei Mechanismen gebildet werden: der eine ist auf die sogenannte ESCRT-Maschinerie (Endosomal Sorting Complexes Required for Transport) angewiesen, der andere ist ESCRT-unabhängig (Abb. 2).
Wovon hängt das Schicksal der intraluminalen Vesikel ab?
Die weitere Entwicklung der intraluminalen Vesikel hängt vom Schicksal der multivesikulären Endosomen ab, in denen sie sich befinden. Verwirrenderweise gibt es zusätzlich zu den verschiedenen Arten von intraluminalen Vesikeln auch unterschiedliche multivesikuläre Endosomen,6 und wovon das Schicksal dieser Endosomen abhängt, ist eine interessante Frage. Multivesikulären (also späten bzw. reifen) Endosomen stehen mehrere Möglichkeiten offen (Abb. 2): Sie verschmelzen entweder mit Lysosomen (wo ihr Inhalt abgebaut und wiederverwertet wird) oder mit der Plasmamembran (wo die intraluminalen Vesikel als Exosomen freigesetzt werden), wie ich bereits erwähnt habe. Darüber hinaus können sie auch zur Bildung von spezialisierten Organellen beitragen. Für die Entscheidung, welcher Weg eingeschlagen wird, scheint die Cholesterinkonzentration in der Membran der multivesikulären Endosomen eine Rolle zu spielen.7
Welcher Mechanismus darüber entscheidet, ob ein intraluminales Vesikel als Exosom freigesetzt wird oder nicht, bleibt vorerst ein Rätsel.
Setzen alle Zellen Exosomen frei?
Da nicht alle Zellen über ein Endomembransystem verfügen, lautet die Antwort auf diese Frage: Nein. Die meisten Zellen von Säugetieren besitzen allerdings Endomembranen und sind deshalb fähig, intraluminale Vesikel innerhalb von multivesikulären Endosomen zu erzeugen. Für die meisten Zelltypen gilt jedoch, dass über die Freisetzung von Exosomen herzlich wenig bekannt ist.
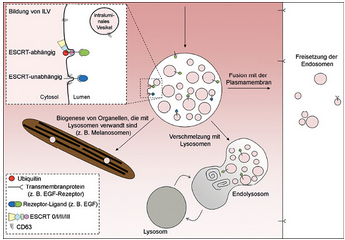
Abb. 2: Intraluminale Vesikel entstehen durch Einstülpungen der Endosomenmembran (oben links). Späte Endosomen, die in ihrem Lumen intraluminale Vesikel akkumulieren, haben drei Optionen: Sie können ihren Inhalt für die Biogenese von spezialisierten Organellen, die mit Lysosomen verwandt sind, zur Verfügung stellen, sie können mit Lysosomen verschmelzen oder aber mit der Plasmamembran, wo die nach außen freigesetzten intraluminalen Vesikel nun als „Exosomen" bezeichnet werden.
Einige Zellen, beispielsweise Immunzellen wie B-Lymphozyten, dendritische Zellen und Mastzellen, scheinen grundsätzlich Exosomen freizusetzen – deshalb ist es keine Überraschung, dass die meisten Informationen, die wir über diese extrazellulären Vesikel besitzen, von Immunzellen stammen. Abgesehen davon, dass Immunzellen eigenständig Exosomen sezernieren, können sie auch durch zelluläre Interaktionen zur Freisetzung animiert werden. Im Grunde genommen können alle Interaktionen zwischen Lymphozyten mit der Freisetzung von Exosomen einhergehen. Menschliche T-Lymphozyten (darunter primäre T-Zellen aus dem Blut, T-Zell-Klone und Jurkat-Zelllinien) geben Exosomen ab, sobald ihre Antigenrezeptoren aktiviert werden.8 B-Lymphozyten wiederum setzen mehr Exosomen frei, wenn sie auf antigenspezifische T-Helferzellen treffen.9
Andere Zelltypen können mithilfe von Calcium-Ionophoren oder anderen Stimuli10,11dazu veranlasst werden, Exosomen zu sezernieren. In welchem Ausmaß Nicht-Immunzellen im Rahmen ihrer normalen physiologischen Funktionen Exosomen abgeben, ist allerdings so gut wie nicht bekannt.
Was geschieht, wenn Exosomen auf eine Empfängerzelle treffen?
Das wissen wir nicht genau. Exosomen, die Membranproteine oder den Inhalt der Endosomen in andere Zellen schleusen, werden entweder vollständig von der Plasmamembran der Empfängerzelle umschlossen oder verschmelzen mit derselben (Abb. 3). Um eine physiologische Wirkung zu erzielen, müssen Exosomen andererseits nicht von den Zielzellen aufgenommen werden: Beispielsweise tragen follikuläre dendritische Zellen auf ihrer Zelloberfläche Exosomen mit sich herum. Dadurch sind sie in der Lage, Immunzellen zu aktivieren, mit denen sie zusammenwirken.12
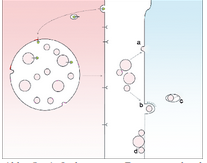
Abb. 3: Aufnahme von Exosomen durch eine Empfängerzelle. Nach der Verschmelzung von multivesikulären Endosomen mit der Zelloberfläche werden die intraluminalen Vesikel als Exosomen freigesetzt. Um eine Wirkung in der Empfängerzelle zu entfalten, verschmelzen Exosomen entweder mit der Plasmamembran (a) oder werden durch Endozytose als Ganzes aufgenommen (b). In der Folge muss das Exosom an das Zytosol weitergeleitet werden, beispielsweise durch „Rückfusion“ (c). Alternativ dazu können sich Exosomen auch an die Oberfläche einer Empfängerzelle heften, um dort eine Signalwirkung zu entfalten (d).
Für den Austausch von extrazellulären Vesikeln zwischen Zellen wurden verschiedene Formen der Phagozytose und Endozytose beschrieben. Welcher Mechanismus im Einzelnen zum Tragen kommt, könnte von der Größe der Vesikel abhängen, die wiederum mit dem Inhalt zusammenhängt. Damit das Material von der Empfängerzelle aufgenommen werden kann, müssen die Exosomen mit der Wirtszelle verschmelzen. Diese Verschmelzung kann entweder unmittelbar mit der Plasmamembran erfolgen oder in einem „Rückfusions“-Schritt im Anschluss an die Aufnahme des Exosoms, bei dem ein endozytotisches Organell der Empfängerzelle zum Einsatz kommt.
Ob Exosomen nun mit den Empfängerzellen verschmelzen oder durch Interaktionen mit Proteinen der Zelloberfläche wirken (oder beides), ist eine grundlegende Fragestellung der Zellbiologie, über die wir mehr in Erfahrung bringen müssen, wenn wir die normalen physiologischen Funktionen von Exosomen besser verstehen wollen.
Welche biologischen Funktionen konnten nachgewiesen werden?
Es existieren zahlreiche Ansichten über die Aufgaben von Exosomen, doch am besten abgesichert sind die Funktionen im Zusammenhang mit der Immunantwort. In frühen Versuchen13konnte nachgewiesen werden, dass aus B-Lymphozyten isolierte Exosomen, die MHC-Moleküle enthalten, T-Lymphozyten in vitro aktivieren, was dafür spricht, dass die Exosomen auf die gleiche Weise mit T-Lymphozyten kommunizieren wie die B-Zellen, aus denen sie stammen. In einer späteren Arbeit dieser Forschergruppe konnte nachgewiesen werden, dass Exosomen aus dendritischen Zellen, die darauf spezialisiert sind, T-Lymphozyten während der Einleitung einer Immunreaktion zu aktivieren, die antitumorale Immunantwort bei Mäusen stärken konnten.14Dadurch wurde das Interesse an einer möglichen praktischen Anwendung geweckt.
Exosomen könnten jedoch auch in Zellen Funktionen erfüllen, die nicht an der Immunantwort beteiligt sind, da verschiedene Nicht-Immunzellen Exosomen sezernieren. Die einzige physiologische Rolle, die bis jetzt bei Zellen nachgewiesen wurde, die nicht zum Immunsystem gehören, betrifft Exosomen aus Keratinozyten. Es konnte gezeigt werden, dass sie die Melaninsynthese regulieren, indem sie die Expression und Aktivität von Proteinen innerhalb der Melanosomen erhöhen, die mit der Pigmentierung der Haut betraut sind.15
Wie beeinflussen Exosomen die Empfängerzellen?
Exosomen beliefern die Empfängerzellen nicht nur mit Proteinen und Fetten, sondern auch mit Messenger-RNA (mRNA) und Mikro-RNA (miRNA); In-Vitro-Experimente haben gezeigt, dass sich diese RNAs auf die Funktion der Empfängerzellen auswirken. So lassen sich Exosomen von Mäusen in menschliche Zellen einschleusen, die daraufhin die übertragene mRNA in Mausprotein übersetzen.16Mikro-RNAs, doppelsträngige RNA-Moleküle, die bestimmte mRNAs (und damit die Proteinsynthese) regulieren können, beeinflussen die Funktion der Empfängerzellen in ähnlicher Weise.
In der Krebsforschung ist die biologische Funktion der Exosomen in den Mittelpunkt des Interesses gerückt. So konnte nachgewiesen werden, dass Exosomen aus Brustkrebszelllinien im Vergleich zu gesunden Brustzelllinien einen erhöhten Anteil an Mikro-RNAs besitzen.17Im Vergleich zu Kontrollgruppen ist außerdem die Vesikelkonzentration im Blutserum bei manchen Krebspatienten erhöht. Ob es sich dabei um Exosomen oder andere extrazelluläre Vesikel handelt (oder um eine Mischung), ist allerdings noch nicht restlos geklärt – auf dieses immer wiederkehrende Problem der Exosomenforschung habe ich bereits hingewiesen.
Exosomen können also auch zur Entstehung von Krankheiten beitragen?
Ja, durchaus. Da sie mit der interzellulären Kommunikation betraut sind, tragen Exosomen mitunter auch zur Verbreitung schädlicher Informationen bei. Sie können nachweislich verschiedene Moleküle enthalten, die mit Krankheiten in Verbindung gebracht werden – nicht nur Mikro-RNA, wie das Krebsbeispiel illustriert hat. Hier sind bestimmte Proteine zu nennen, die bei neurodegenerativen Krankheiten eine Rolle spielen, beispielsweise Beta-Amyloid18bei Alzheimer, das Tau-Protein19(bei verschiedensten neurodegenerativen Erkrankungen), Prionen20(bei übertragbaren spongiformen Enzephalopathien), Alpha-Synuclein21(bei den sogenannten Synucleinopathien, zu denen Parkinson zählt), aber auch Superoxid-Dismutase-122 (bei der amyotrophen Lateralsklerose). Daher wird vermutet, dass Exosomen die Verbreitung neurodegenerativer Proteine unterstützen, auch wenn sich dieses Szenario für manche Inhalte deutlicher abzeichnet als für andere.

Man weiß noch immer wenig darüber, wie krankheitsauslösende Faktoren von einer Zelle in die andere gelangen, doch Exosomen wären ein mögliches Transportmittel. Dass bei Alzheimer exosomale Proteine wie Alix zusammen mit senilen Plaques auftreten, erhärtet die Vermutung, dass Exosomen bei der Verteilung eine Vermittlerrolle einnehmen. Unsere Hoffnung besteht darin, eine Methode zu entwickeln, mit deren Hilfe wir die Freisetzung und Verbreitung von Exosomen regulieren können, um wenigstens einen Teil der genannten Krankheiten zu bekämpfen – doch muss noch viel mehr über die biologischen Grundlagen in Erfahrung gebracht werden, bevor es so weit ist.
Ich bin schon völlig durcheinander: Wie wird festgelegt, was Exosomen enthalten?
Exosomen enthalten, was immer bei ihrer Entstehung (als intraluminale Vesikel) in sie hineinsortiert wird. Bei Membranproteinen geschieht dies mithilfe von Markierungen mit Ubiquitin, denn Ubiquitin ist die Voraussetzung dafür, dass die ESCRT-Maschinerie in Gang gesetzt wird und es zur Produktion von ESCRT-abhängigen intraluminalen Vesikeln kommt.
Zum gegenwärtigen Zeitpunkt ist nicht bekannt, durch welchen Mechanismus zytosolische Moleküle angereichert werden. Vergleicht man beispielsweise die Menge an Mikro-RNAs in Exosomen und ihren Elternzellen, so wird deutlich, dass Mikro-RNAs nicht nach dem Zufallsprinzip von Exosomen aufgenommen, sondern offensichtlich angereichert werden. Trotzdem ist unklar, weshalb manche Mikro-RNAs stärker konzentriert sind als andere.
Weil es schwierig ist, Exosomen von anderen extrazellulären Vesikeln zu unterscheiden, besteht eine gewisse Wahrscheinlichkeit dafür, dass einige der Inhalte, die angeblich in „Exosomen“ angereichert sind, in Wirklichkeit auf Kontamination durch andere Vesikel beruhen. Viele Forscher verhalten sich sehr pingelig, wenn es darum geht, die Etiketten „Exosomen“ und „extrazelluläre Vesikel“ korrekt zu gebrauchen, aber leider nicht alle. Dazu kommt, dass, wie ich weiter oben angemerkt habe, zytosolische Proteine wohl auch in Exosomenaufbereitungen angetroffen werden.
Kann man extrazelluläre Vesikel von Exosomen unterscheiden?
Diese interessante Frage erfordert eine komplexe Antwort. Im Idealfall lassen sich Zellkompartimente durch einen spezifischen biologischen Marker identifizieren. Dies ist zum Beispiel beim Golgi-Apparat, dem Zellkern oder den Mitochondrien der Fall, denn sie alle enthalten Proteine, die man in anderen Organellen nicht oder höchstens in viel geringerer Konzentration antrifft.
Ein Problem besteht darin, dass intraluminale Vesikel und damit Exosomen ein intermediäres Kompartiment darstellen, das sich in einem veränderlichen Organell befindet. Multivesikuläre Endosomen sind keine statischen Organellen, sondern in einem kontinuierlichen Reifeprozess begriffen. Dabei gewinnen sie bestimmte Proteine hinzu und verlieren andere. Einen Marker, der ausschließlich für Exosomen funktioniert, wird es nie geben, denn jede Fracht auf der Membran der intraluminalen Vesikel bzw. der Exosomen entstammt der Endosomenmembran, und alles, was in den Exosomen enthalten ist, kommt aus dem Zytosol. Eine bestimmte Fracht, die auf oder in intraluminalen Vesikeln bzw. Exosomen angereichert ist, kann auch an anderer Stelle vorhanden sein. CD63 könnte man als Pseudomarker für Exosomen ansehen. Mehrere derartige Tetraspanine treten in intraluminalen Vesikeln und Exosomen in erhöhter Konzentration auf, und meine Kollegen und ich haben nachgewiesen, dass CD63 für die ESCRT-unabhängige Bildung von ILV erforderlich ist.23
Demnach gibt es keinen zuverlässigen Marker für Exosomen?
Vermutlich trifft das sogar zu, zumindest gibt es nicht den einen verlässlichen Marker. Im Endeffekt lassen sich Exosomen möglicherweise am besten biochemisch identifizieren, wenn man eine Kombination von Markern – Tetraspanine, Alix und andere – verwendet und gleichzeitig Proteine, die in der Plasmamembran vorkommen, ausschließt. Obwohl ILV/Exosomen naturgemäß einige Plasmamembranproteine enthalten und in der Plasmamembran einige ILV/exosomale Proteine vorkommen, sollte es möglich sein, den relativen Gehalt und/oder die Anreicherung von exosomalen Proteinen heranzuziehen, um die Exosomen von anderen extrazellulären Vesikeln zu unterscheiden. Frachten wie das in B-Zellen enthaltene MHC II und weitere zelltypspezifische Antigene könnten ebenfalls hilfreich sein, um Exosomen von anderen Vesikeln abzugrenzen. Es gibt eine Online-Datenbank, in der Proteine, Lipide und RNA aus veröffentlichten sowie unveröffentlichten Studien zum Thema Exosomen aufgelistet sind.24
Wie werden Exosomen isoliert und untersucht, wenn es so schwer ist, sie zuverlässig zu charakterisieren?
Mithilfe gängiger Methoden können Exosomen selten dargestellt werden, denn sie sind zu klein, um mithilfe der Fluoreszenzmikroskopie erfasst zu werden, und ihre Freisetzung ist unter Umständen ein seltenes Ereignis. Einige Studien haben unter Verwendung verschiedener elektronenmikroskopischer Methoden die Freisetzung von Exosomen in Zellkulturen abgebildet, normalerweise reichert man aber eher Exosomen aus dem Zellüberstand oder aus tierischen Körperflüssigkeiten an. Es ist üblich, Exosomen durch differenzielle Zentrifugation aus einem Kulturmedium zu isolieren. Mit zunehmender Zentrifugationsgeschwindigkeit werden zuerst größere Verunreinigungen abgeschieden; anschließend setzen sich bei einer sehr hohen Geschwindigkeit (~100.000 × g)25 Exosomen, kleine extrazelluläre Vesikel und sogar Proteinansammlungen ab.

Daher enthalten derartige Aufbereitungen eher angereichertes als gereinigtes Material. Angereicherte Aufbereitungen werden für gewöhnlich biochemisch, durch Massenspektrometrie oder mit dem Elektronenmikroskop analysiert. Sofern bei der Elektronenmikroskopie isolierte Fraktionen als Komplettpräparat erfasst werden, ist es möglich, Vesikel mit Antikörpern einzufärben. Allerdings stehen bei (durch Zentrifugation) isolierten Präparaten nicht dieselben internen Kontrollen zur Verfügung wie bei der Antikörperfärbung von Zellbereichen. Bemerkenswerterweise wurde der Beschreibung von Exosomen bisher wenig Aufmerksamkeit gezollt, obwohl man sich mittlerweile bemüht, dieses Versäumnis durch die Festlegung von Richtlinien und Kriterien wiedergutzumachen, um die verschiedenen Gruppen von extrazellulären Vesikeln zu definieren.26
Was sind die wichtigsten Themen in der Exosomenforschung?
Es ist zweifellos am allerwichtigsten, die biologische Bedeutung dieser Strukturen zu verstehen. Wenn man dermaßen wenig über ihre grundlegenden physiologischen Funktionen weiß, ist es schwer nachzuvollziehen, dass Exosomen an der Entstehung so vieler verschiedener Krankheiten beteiligt sein sollen. Grundlegende Fragen über die Bildung von Exosomen, ihr Schicksal und ihre normale Funktion sind noch immer ungelöst, doch letztlich gilt, dass man zuerst ILV verstehen muss, wenn man sich von Exosomen ein Bild machen möchte – dies wird häufig übersehen. Bis dahin müssen einschlägige Veröffentlichungen die Kriterien, die angewendet werden, um Exosomen von anderen extrazellulären Vesikeln zu unterscheiden, klar und sorgfältig beschreiben, um Verwirrung zu vermeiden und damit Skepsis zu fördern.
Anmerkung der Redaktion
Der vorliegende Text wurde am 13. Juni 2016 vom Cambridge-Forscher J. R. Edgar im Journal BMC Biology unter einer Creative-Commons-Lizenz (https://bit.ly/creacomm40) zur freien Nutzung veröffentlicht und ist inhaltlich nach wie vor aktuell. Um die Lesbarkeit zu verbessern, haben wir ihn einiger allzu fachspezifischer Ausführungen und Endnoten beraubt und um ein Glossar ergänzt. Das englischsprachige Original „Q&A: What are exosomes, exactly?“ finden Sie unter https://bit.ly/edgar-exosomes.
Endnoten
- Harding, C. et al.: „Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes“ in J Cell Biol, 1983, 97(2):329–39
- Pan, B. T. et al.: „Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes“ in J Cell Biol, 1985, 101(3):942–8
- Johnstone, R. M. et al.: „Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)“ in J Biol Chem, 1987, 262(19):9412–20
- Kim, M. S. et al.: „Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells“ in Nanomedicine, 2015, 12(3):655–64
- McDonald, B. und Martin-Serrano, J.: „No strings attached: the ESCRT machinery in viral budding and cytokinesis“ in J Cell Sci, 2009, 122(Pt 13):2167–77
- White, I. J. et al.: „EGF stimulates annexin 1-dependent inward vesiculation in a multivesicular endosome subpopulation“ in EMBO J, 2006, 25(1):1–12
- Mobius, W. et al.: „Immunoelectron microscopic localization of cholesterol using biotinylated and non-cytolytic perfringolysin O“ in J Histochem Cytochem, 2002, 50(1):43–55
- Blanchard, N. et al.: „TCR activation of human T cells induces the production of exosomes bearing the TCR/CD3/zeta complex“ in J Immunol, 2002, 168(7):3235–41
- Muntasell, A. et al.: „T cell-induced secretion of MHC class IIpeptide complexes on B cell exosomes“ in EMBO J, 2007, 26(19):4263–72
- Savina, A. et al.: „Exosome release is regulated by a calcium-dependent mechanism in K562 cells“ in J Biol Chem, 2003, 278(22):20083–90
- Guo, B. B. et al.: „Stimulating the release of exosomes increases the intercellular transfer of prions“ in J Biol Chem, 2016, 291(10):5128–37
- Denzer, K. et al.: „Follicular dendritic cells carry MHC class II-expressing microvesicles at their surface“ in J Immunol, 2000, 165(3):1259–65
- Raposo, G. et al.: „B lymphocytes secrete …“, a. a. O.
- Zitvogel, L. et al.: „Eradication of established murine tumors …“, a. a. O.
- Lo Cicero, A. et al.: „Exosomes released by keratinocytes modulate melanocyte pigmentation“ in Nat Commun, 2015, 6:7506
- Valadi, H. et al.: „Exosomemediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells“ in Nat Cell Biol, 2007, 9(6):654–9
- Melo, S. A. et al.: „Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis“ in Cancer Cell, 2014, 26(5):707–21
- Rajendran, L. et al.: „Alzheimer’s disease beta-amyloid peptides are released in association with exosomes“ in Proc. Natl. Acad. Sci. USA, 2006;103(30):11172–7
- Saman, S. et al.: „Exosomeassociated tau is secreted in tauopathy models and is selectively phosphorylated in cerebrospinal fluid in early Alzheimer disease“ in J Biol Chem, 2012, 287(6):3842–9
- Fevrier, B. et al.: „Cells release prions in association with exosomes“ in Proc Nat Acad Sci USA, 2004, 101(26):9683–8
- Emmanouilidou, E. et al.: „Cell-produced alpha-synuclein is secreted in a calciumdependent manner by exosomes and impacts neuronal survival“ in J Neurosci, 2010, 30(20):6838–51
- Gomes, C. et al.: „Evidence for secretion of Cu, Zn superoxide dismutase via exosomes from a cell model of amyotrophic lateral sclerosis“ in Neurosci Lett, 2007, 428(1):43–6
- Edgar, J. R. et al.: „Hrs- and CD63-dependent competing mechanisms make different sized endosomal intraluminal vesicles“ in Traffic, 2014, 15(2):197–211
- ExoCarta: http://www.exocarta.org
- Thery, C. et al.: „Isolation and characterization of exosomes from cell culture supernatants and biological fluids“ in Curr Protocols Cell Biol, 2006, Chapter 3:Unit 3 22
- Lotvall, J. et al.: „Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles“ in J Extracell Vesicles, 2014, 3:26913
Kommentare
Kommentar von Klaus Schönfeld (08. April 2022, 11:03 Uhr)
Nachdem ich mich in das Thema, danke für ihren Bericht, btw,
Sind exosome am "entgiften" von Zellen beteiligt.
Desweiteren sind sie, Nachdem von der Zelle freigesetzt als Warner für andere Zellen im Organismus unterwegs.
Sind sind Teil des Kommunikationsytem des Organismus. Es sind Botenstoffe die zeitnah dafür sorgen das eine genetische Anpassung auf veränderte Umweltbedingungen geschieht.
Eins sind sie nicht, Krankheiverbreiter.
Diese Website verwendet Cookies von Google Analytics, sofern Sie zustimmen.
Weitere Informationen finden Sie in unserer
Datenschutzerklärung.
 Immer wieder tauchen sie in der Virendebatte auf, diese ominösen Vesikel. Viren sind nichts anderes als Exosomen, heißt es von Kritikern. Kann das stimmen? Wir haben uns gefragt, wie eigentlich der offizielle Stand der Forschung ist, und Ihnen einen Überblicksartikel übersetzt. Ziehen Sie Ihre eigenen Schlüsse daraus.
Immer wieder tauchen sie in der Virendebatte auf, diese ominösen Vesikel. Viren sind nichts anderes als Exosomen, heißt es von Kritikern. Kann das stimmen? Wir haben uns gefragt, wie eigentlich der offizielle Stand der Forschung ist, und Ihnen einen Überblicksartikel übersetzt. Ziehen Sie Ihre eigenen Schlüsse daraus.



